2017年,美國(guó) FDA 批準(zhǔn)了首款 CAR-T 細(xì)胞療法上市,人類進(jìn)入細(xì)胞**時(shí)代,CAR-T 細(xì)胞療法在血液類癌癥中取得了很好的臨床效果。
目前,已上市的幾款 CAR-T 療法都是使用的來(lái)自癌癥患者自身的自體 T 細(xì)胞,自體細(xì)胞療法的優(yōu)勢(shì)在于能夠在患者體內(nèi)長(zhǎng)時(shí)間發(fā)揮作用,且不產(chǎn)生排異反應(yīng),但該方法也存在著許多局限性,自體細(xì)胞療法耗時(shí)長(zhǎng),一些急性白血病患者沒(méi)有足夠時(shí)間等待,此外,許多病情嚴(yán)重的患者沒(méi)有足夠的 T 細(xì)胞用于工程化改造,也沒(méi)有足夠的時(shí)間來(lái)等待改造。
因此,許多研究團(tuán)隊(duì)和公司開(kāi)始致力于開(kāi)發(fā)同種異體細(xì)胞療法,異體細(xì)胞療法的細(xì)胞來(lái)源更多樣,可以是外周血、臍帶血,以及人工誘導(dǎo)多能干細(xì)胞(iPSC)等等,該方法更容易批量生產(chǎn),耗時(shí)更少,能夠解決自體細(xì)胞療法的多種局限,也就是所謂的“現(xiàn)貨型”細(xì)胞療法。
以現(xiàn)貨型 CAR-T 療法為代表的同種異體 T 細(xì)胞療法,通常使用基因編輯技術(shù)(主要是 CRISPR-Cas9)來(lái)敲除 T 細(xì)胞受體(TCR)及其他基因,來(lái)避免移植后出現(xiàn)的移植物抗宿主病(GvHD)。
以色列特拉維夫大學(xué)的研究人員在 Nature 子刊 Nature Biotechnology 發(fā)表了題為:Frequent aneuploidy in primary human T cells after CRISPR–Cas9 cleavage 的研究論文。
該研究使用單細(xì)胞 RNA 測(cè)序技術(shù)驗(yàn)證了 CRISPR-Cas9 基因編輯人類原代 T 細(xì)胞后的結(jié)果,檢測(cè)結(jié)果顯示,CRISPR-Cas9 編輯的目標(biāo)基因所在的染色體出現(xiàn)了頻繁的染色體非整倍性(染色體數(shù)目的增加或減少)和染色體截短。
這項(xiàng)研究結(jié)果表明,染色體的非整倍性和截短是 CRISPR-Cas9 切割 DNA 雙鏈后的常見(jiàn)結(jié)果,因此,在使用 CRISPR-Cas9 基因編輯的臨床試驗(yàn)中,尤其是基于 CRISPR-Cas9 的細(xì)胞療法開(kāi)發(fā)中,應(yīng)當(dāng)特別注意監(jiān)測(cè)和盡量降低這種潛在的嚴(yán)重染色體變異。

2020年2月,CAR-T 之父 Carl June 教授等人在 Science 期刊發(fā)表論文,報(bào)道了頭個(gè)基于基因編輯的 CAR-T 療法**癌癥的人體臨床試驗(yàn)結(jié)果。
該研究通過(guò) CRISPR-Cas9 基因編輯敲除了 T 細(xì)胞上的 TCR 和 PD-1,TCR 蛋白的 α 鏈(TCRα)由 TRAC 基因表達(dá),該基因位于14號(hào)染色體;TCR 蛋白的 β 鏈(TCRβ)由 TRBC 基因表達(dá),該基因位于7號(hào)染色體;PD-1蛋白由 PDCD1 基因表達(dá),該基因位于2號(hào)染色體。
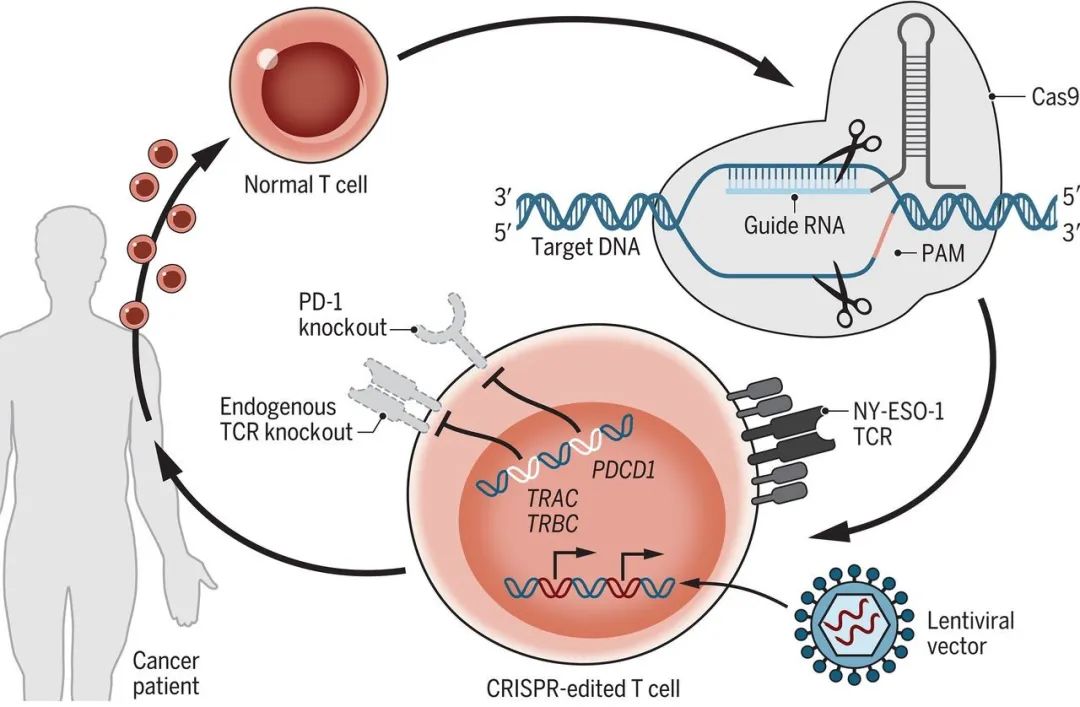
圖片來(lái)自 Science 論文【2】
在這篇*新論文中,研究團(tuán)隊(duì)使用 CRISPR-Cas9 基因編輯技術(shù)來(lái)敲除人原代 T 細(xì)胞的表達(dá) TCR 和 PD-1 的基因,而且使用了和上述 Science 論文中同樣的 gRNA 來(lái)靶向敲除 TCR 和 PD-1。然后使用單細(xì)胞 RNA 測(cè)序來(lái)研究編輯后的人原代 T 細(xì)胞的結(jié)果。
實(shí)驗(yàn)結(jié)果顯示,在基因編輯4天后,相當(dāng)比例的原代 T 細(xì)胞出現(xiàn)了染色體異常。具體來(lái)說(shuō),9%的原代 T 細(xì)胞出現(xiàn)了14號(hào)染色體缺失,1.4%的原代 T 細(xì)胞出現(xiàn)了14號(hào)染色體增加,表達(dá) TCRα 的基因位于14號(hào)染色體。9.9%的原代 T 細(xì)胞出現(xiàn)了7號(hào)染色體截?cái)?/span>,表達(dá) TCRβ 的基因位于7號(hào)染色體。而在編輯的第11天后,仍有0.9%的原代 T 細(xì)胞存在14號(hào)染色體缺失,進(jìn)一步證實(shí)了這種染色體變異的長(zhǎng)期存在。
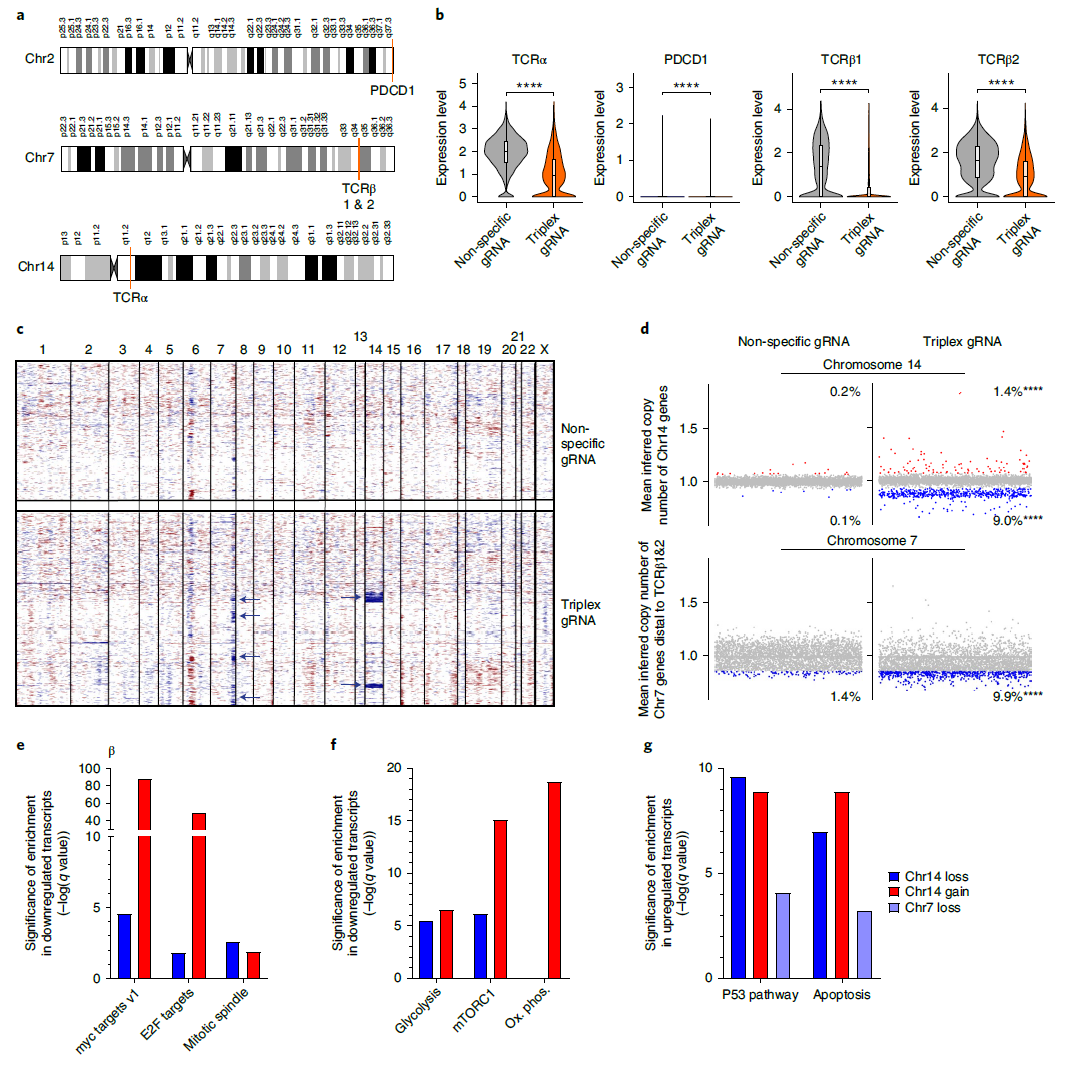
這項(xiàng)研究表明,染色體非整倍性(染色體數(shù)目的增加或減少)和染色體截?cái)啵?CRISPR-Cas9 基因編輯時(shí)對(duì) DNA 雙鏈進(jìn)行切割后導(dǎo)致的常見(jiàn)后果,因此,在臨床應(yīng)用中,應(yīng)當(dāng)進(jìn)行相應(yīng)的檢測(cè)并盡量使其風(fēng)險(xiǎn)*小化。
此前已經(jīng)有大量研究發(fā)現(xiàn)并證實(shí),CRISPR-Cas9 基因編輯,由于 Cas9 造成的 DNA 雙鏈斷裂,導(dǎo)致細(xì)胞出現(xiàn)染色體大片段堿基缺失、染色體碎裂、重排等嚴(yán)重染色體異常。這些發(fā)現(xiàn)提醒了我們應(yīng)當(dāng)加強(qiáng)對(duì) CRISPR 基因編輯技術(shù)潛在風(fēng)險(xiǎn)的評(píng)估和監(jiān)測(cè)。
需要指出的是,堿基編輯(Base Editing),能夠在不造成 DNA 雙鏈斷裂的情況下進(jìn)行基因編輯,堿基編輯技術(shù)開(kāi)創(chuàng)者劉如謙教授創(chuàng)立的 Beam therapeutics,以及國(guó)內(nèi)的貝斯生物等,正在通過(guò)堿基編輯技術(shù)開(kāi)發(fā)通用型細(xì)胞療法,理論上能夠避免 CRISPR-Cas9 基因編輯導(dǎo)致的染色體異常,具有更好的**性。
